Una molecola di acqua è molto semplice, è composta da 2 atomi di idrogeno uniti ad 1 atomo di ossigeno da 2 legami covalenti singoli.
La polarità delle molecole dell'acqua determina la formazione dei legami
ad idrogeno e dato che l'atomo di ossigeno è più elettronegativo
dell'idrogeno, gli elettroni dei 2 legami polari passano più tempo
vicino all'atomo di ossigeno, formando legami covalenti polari.
La molecola dell'acqua è a forma di V ed è una molecola polare
dato che ha 2 estremità cariche di segno opposto, la regione dell'atomo
di ossigeno con carica parziale negativa e quella di idrogeno parziale
positiva.
L'acqua ha dunque un'attrazione tra le sue molecole polari vicine, la
debole carica positiva dell'idrogeno viene attirata dalla carica
negativa dell'atomo di ossigeno di una molecola vicina.
Ogni molecola d'acqua può formare legami ad idrogeno con un massimo di 4 molecole vicine.
L'acqua ha 4 qualità principali indispensabili per la vita:
1 - Proprietà coesive
Quando si trova nello stato liquido, l'acqua forma legami a idrogeno molto deboli, che si formano e si rompono molto velocemente.
La coesione si ha quando i legami a idrogeno tengono insieme l'acqua liquida, con questi continui agganci e separazione. La coesione è molto importante ad esempio perchè permette all'acqua di vincere la forza di gravità, permettendo quindi lo spostamento dell'acqua dal basso verso l'alto nelle piante.
Anche l'adesione è importante, consiste nella stretta associazione tra una sostanza ad un'altra, cosa anch'essa utile per vincere la resistenza della forza di gravità grazie all'adesione con altre molecole.
La tensione superficiale è la difficoltà con cui può essere estesa oppure interrotta la superficie di un liquido.
La ts può essere vista come una pellicola invisibile che ricopre la superficie dell'acqua, ed essa può essere visibile quando lanciamo un sasso nell'acqua facendolo rimbalzare, quando riempiamo un bicchiere fino all'orlo o quando alcuni insetti galleggiano o camminano sull'acqua.
2 - La capacità di stabilizzare la temperatura
L'acqua stabilizza la temperatura dell'aria assorbendone calore quando questa è più calda, e dandogli calore quando questa è più fredda.
Tutto ciò che ha movimento possiede energia cinetica che rappresenta l'energia del movimento, e tanto maggiore è la velocità di una molecola e tanto maggiore è la sua energia cinetica.
Il calore è la misura della quantità totale dell'energia cinetica dovuta al moto molecolare nella materia.
La temperatura misura l'intensità di calore dovuta all'energia cinetica media delle molecole.
Quindi tanto maggiore è la temperatura di un corpo e tanto più veloci sono le molecole, e viceversa.
Quando due corpi di diversa temperatura sono a contatto, il calore passa dall'oggetto più caldo a quello più freddo, fino a che entrambi raggiungono la stessa temperatura.
La temperatura si misura in gradi celsius °C.
L'acqua ad esempio, al livello del mare congela a 0°C e bolle a 100, la temperatura media del corpo umano è 37 gradi, mentre la temperatura ottimale di una stanza è 20-25 °C.
La caloria (cal) corrisponde alla quantità di energia termica necessaria per innalzare di 1°C la temperatura di 1 g d'acqua, e rappresenta anche la quantità di calore liberata da 1g d'acqua quando questo viene raffreddato di 1°C.
Analogamente, la chilocaloria (kcal) equivale a 1000 calorie, e viene rapportata al Kg d'acqua.
Il joule (j) corrisponde a 0,239 cal, una caloria equivale a 4,184 joule.
Il calore specifico di una sostanza è la quantità di calore che deve essere assorbito o perso da 1g di quella sostanza perchè aumenti o diminuisca la sua temperatura di 1°C.
L'acqua ha un calore specifico elevato, ne consegue che ha la capacità di assorbire o liberare quantità relativamente grandi di calore variando poco la propria temperatura.
L'elevato calore specifico dell'acqua è dovuto ai legami a idrogeno, dato che gran parte dell'energia termica viene impiegata per distruggere i legami ad idrogeno.
L'elevato calore specifico dell'acqua: rende le temperature degli oceani stabili favorendo l'ambiente alla vita, rende il clima ambientale stabile e favorevole alla vita, fornisce agli organismi (che ricordiamo sono composti per la maggior parte d'acqua) più resistenza ai cambiamenti della temperatura corporea.
Evaporazione
Quando le molecole di un liquido si muovono troppo velocemente (a temperature elevate) possono sfuggire all'attrazione delle altre molecole vicine, allontanandosi dal liquido e passando nell'aria come gas, creando il fenomeno dell'evaporazione.
L'evaporazione cmq può avvenire a qualsiasi temperatura.
Il calore di vaporizzazione è la quantità di calore che un liquido deve assorbire perchè un grammo di questo passi allo stato di gas.
L'acqua possiede un elevato calore di vaporizzazione rispetto agli altri liquidi, per far evaporare 1g d'acqua sono necessarie 580cal di energia termica, questa proprietà emergente dell'acqua è anch'essa dovuta ai legami ad idrogeno, dato che devono essere interrotti prima che le molecole possano passare allo stato gassoso.
Questa proprietà contribuisce alla vita sulla terra, grazie alla creazione di un clima mite.
Il raffreddamento per evaporazione si ha perchè le molecole più calde sono quelle che in percentuale maggiore lasciano il liquido passando allo stato gassoso.
Anche queste proprietà sono importanti, ad esempio nell'uomo la sudorazione serve a raffreddare l'elevata temperatura corporea.
L'umidità invece crea disagio perchè una grossa concentrazione di vapore acqueo impedisce l'evaporazione del sudore, e questo accade spesso nelle città d'estate.
3 - L'espansione dovuta al congelamento
L'acqua è una delle poche sostanze che allo stato solido è meno densa che nello stato liquido, e ciò permette al ghiaccio di galleggiare, questo sempre per via dei legami ad idrogeno, in quanto l'acqua inizia a congelare quando le sue molecole non si muovono abbastanza fortemente per rompere i legami ad idrogeno (a 0°C) e quando ciò accade le molecole di acqua si fissano in un legame cristallino.
L'acqua invece raggiunge la sua massima densità a 4°C, dopodichè inizia ad espandersi nuovamente a causa dell'aumento della velocità delle sue molecole.
Il galleggiamento del ghiaccio è importante perchè se così non fosse tutti i laghi e gli oceani si ghiaccerebbero completamente e non ci sarebbe più vita, mentre con il ghiaccio in superficie la temperatura dell'acqua rimane cmq adeguata per la vita.
4 - L'acqua come solvente della vita
Una soluzione è una miscela omogenea di due o più sostanze, dove l'agente dissolvente è detto solvente, mentre la sostanza disciolta è detta soluto.
Una soluzione acquosa è una sostanza dove il solvente è l'acqua.
L'acqua è il miglior solvente esistente, e ciò è dovuto alla polarità delle sue molecole, ma non tutto può essere soluto dall'acqua.
Il guscio d'idratazione è la sfera di molecole di acqua che circonda ogni ione in soluzione.
Per potersi sciogliere in acqua un composto non deve essere per forza di tipo ionico, ma possono essere sciolti anche i composti polari come gli zuccheri, e anche le macromolecole come le proteine possono sciogliersi in acqua se possiedono sulla superficie regioni ionizzate o polari.
Qualsiasi sostanza dotata di affinità con l'acqua è detta idrofila, mentre le sostanze che non si sciolgono e non hanno nessun'altra affinità (tipo l'assorbirmento) vengono dette idrofobe, dove ad esempio i legami apolari simmetrici impediscono ogni affinità, e nel caso delle membrane cellulari questo è molto importante perchè non si sciolgano.
La chimica biologica è la chimica delle soluzioni, dato che la maggior parte delle reazioni chimiche che si verificano negli esseri viventi implicano la partecipazione di soluti sciolti in acqua.
Una mole (mol) di una sostanza è il numero di grammi di quella sostanza uguale al peso molecolare della sostanza stessa.
Il peso molecolare è la somma dei pesi di tutti gli atomi presenti in una molecola.
Una mole di una determinata sostanza contiene esattamente sempre lo stesso numero di molecole.
Quindi se ad esempio ho il saccarosio C12H22O11, il peso molecolare del saccarosio equivale a 342 dalton, dato che 1 atomo di carbonio pesa 12 dalton, uno di idrogeno pesa 1 dalton e 1 di ossigeno pesa 16 dalton ((12*12)+(1*22)+(16*11)), e quindi per ottenere 1 mol di saccarosio occorre pesare 342g della sostanza.
Il numero avogadro è il numero di molecole contenute in una mole di una sostanza, ed è una costante pari a 6,02*1023.
L'uso delle moli consente agli scienziati di combinare sostanze in rapporti molecolari fissi.
La molarità è il numero di soluti per litro di soluzione.
Dissociazione delle molecole d'acqua
Ogni tanto un atomo di idrogeno condiviso da 2 molecole d'acqua in legame a idrogeno si sposta da una molecola ad un'altra lasciando il proprio elettrone, trasferendo soltanto uno ione idrogeno (H+), ovvero un singolo protone con carica +1.
La molecola di acqua che ha perduto il protone diventa uno ione idrossido (OH-) con carica elettrica -1, il protone si lega all'atra molecola d'acqua che si trasforma in ione idronio (H3O+), la dissociazione avviene dunque così: H2O <--> H+ + OH-
La dissociazione delle molecole d'acqua è reversibile e molto rara, ma è lo stesso molto importante dato che gli ioni di idrogeno e idrossido sono estremamente rattivi e piccole variazioni della loro concentrazione possono influenzare drasticamente le proteine e altre molecole complesse presenti nelle cellule.
Un acido è una sostanza capace di aumentare la concentrazione di ioni idrogeno in una soluzione.
Una soluzione acida si ha quando sono presenti più ioni idrogeno che ioni idrossido.
Una base è una sostanza capace di diminuire la concentrazione di ioni idrogeno.
Alcune basi riducono la concentrazione degli ioni idrogeno combinandosi direttamente con essi, altre invece lo fanno dissociandosi liberando ioni idrossido.
Una soluzione basica si ha quando il numero di ioni idrossido è superiore di quello di ioni idrogeno.
Una soluzione neutra si ha quando il numero di questi 2 tipi di ioni è uguale.
Il pH
In qualsiasi soluzione, il prodotto della concentrazione degli ioni idrogeno e degli ioni idrossido ha un valore costante pari a 10-14M.
Se in una soluzione è nota la concentrazione di uno dei 2 tipi di ioni, è nota automaticamente anche l'altra, dato che un acido aggiunge ioni idrogeno e allontana gli ioni idrossido, mentre la base fa il contrario, e quindi se ho 10-4M di idrossido, ho 10-10M di idrogeno.
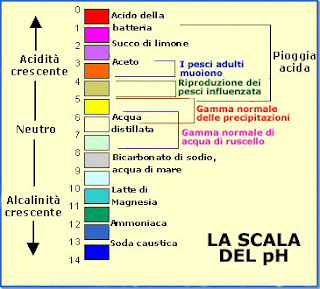
La scala del pH va da 0 a 14 ed indica la variazione della concentrazione di ioni idrogeno e idrossido.
Il pH è il logaritmo negativo in base 10 della concentrazione di ioni idrogeno espressa in moli per litro: pH=-log[H+].
Per una soluzione neutra [H+] è pari a 10-7M, quindi:
pH=-log10-7=-(-7)=7
Il valore del pH diminuisce all'aumentare della concentrazione di ioni idrogeno.
Quindi, il pH di una soluzione neutra è 7 e i valori inferiori nella scala indicano soluzioni acide, mentre quelli superiori indicano soluzioni basiche.
La maggior parte dei liquidi hanno pH tra 6 e 8, e ogni unità di pH rappresenta una differenza di un fattore 10 nella concentrazioni di ioni idrogeno e idrossido.
Un modesto cambiamento di pH di una soluzione indica una sostanziale variazione della concentrazione dei 2 tipi di ioni.
Il pH interno della maggior parte delle cellule è circa 7, e variazioni anche modeste possono essere molto dannose.
I tamponi sono sostanze che rendono minime le variazioni di concentrazione degli ioni idrogeno e idrossido in soluzione.
Nel sangue umano il pH si mantiene intorno a 7,4 grazie ai tamponi, se così non fosse basterebbero pochi minuti per morire se il pH scendesse a 7 o salisse fino a 7,8.
Il tampone agisce legando ioni di idrogeno dalla soluzione da cui essi sono presenti in eccesso oppure cedendo ioni idrogeno quando la loro concentrazione tende a diminuire.
Nel sangue umano l'equilibrio chimico tra acido carbonico e bicarbonato agisce da regolatore del pH, formando un tampone costituito da un acido ed una base in equilibrio tra loro.
Molti tamponi sono appunto coppie di acido-base.
Precipitazioni acide
Le precipitazioni acide sono un problema per l'equilibrio biologico della terra.
La pioggia incontaminata ha un pH di circa 5,6, cioè debolmente acido, quando però questo pH diminuisce sotto il 5,6 a causa dell'inquinamento, si hanno precipitazioni acide.
Le piogge acide sono un problema perchè la forte acidità può alterare la struttura delle molecole biologiche impedendo di portare avanti i processi chimici indispensabili per la vita.
Queste precipitazioni possono avere effetti diretti ben visibili sulle foreste e su altre forme di vita terrestre, ma anche sul terreno, modificando la solubilità delle sostanze minerali.
Piaciuto l'articolo? Lascia un commento!
EmoticonEmoticon